(Ciencias de Joseleg)(Biología)(Introducción y biología
celular)(La
sangre)(Introducción)(Historia)(El
citosol y otros fluidos intracelulares)(Diferentes
tipos de sangre)(Los
colores de la sangre)(Las
funciones de la sangre)(Plasma
sanguíneo y sus componentes)(Propiedades
de la sangre total y su análisis)(Sistema
de grupos sanguíneos)(Glóbulos
rojos o eritrocitos)(Glóbulos
blancos o leucocitos)(Las
plaquetas o trolbocitos)(Hematopoyesis)(Origen
de otros componentes de la sangre)(Referencias
bibliográficas)(Versión
documento word)
La hematopoyesis es un proceso general de formación de elementos que componen la sangre e incluye la eritropoyesis, la granulopoyesis y la trombopoyesis. Todos los elementos sanguíneos tienen un tiempo de vida útil, por lo que se van degradando paulatinamente. El objetivo de la hematopoyesis es el de mantener estables los niveles de los diferentes tipos celulares encontrados en la sangre periférica. Los glóbulos rojos por ejemplo tienen una vida útil de 120 días, las plaquetas por su parte tienen una garantía de 10 días, los leucocitos por otro lado tienen expectativas de vida variables, algunos pueden durar décadas o casi toda la vida como en el caso de los linfocitos B de memoria. En el ser humano adulto los eritrocitos, granulocitos, monocitos y plaquetas se forman al interior del tuétano rojo. Los linfocitos se pueden formar tanto en el tuétano como en los nódulos linfáticos.
Figura 62. El modelo anterior representa los principales procesos
relacionados con la hematopoyesis. Muestra las células sanguíneas desarrollarse
a partir de las células madre hematopoyéticas en el tuétano hasta convertirse
en células funcionales maduras, así como su distribución en la sangre y el
tejido conectivo. En todos los linajes cada flecha de progresión oculta el
hecho de que se da una proliferación mitótica, o lo que es lo mismo, se
producen muchos individuos.
Durante la vida fetal tanto los eritrocitos como los
leucocitos se forman en muchos órganos antes de la diferenciación del
tuétano. La primera etapa es conocida
como etapa vitelina, la cual da inicio en la tercera semana de gestación,
caracterizada por la formación de las islas de sangre en la pared del saco
vitelino. La segunda etapa se denomina hepática, pues el hígado temprano
funciona como órgano hematopoyético. La línea celular más producida en estas
etapas es la eritroide, aunque se ha reportado el desarrollo limitado de la
leucopoyesis en el hígado. El hígado es el principal órgano de formación
sanguínea fetal durante el segundo trimestre de embarazo. El bazo “Spleen” es
el órgano gemelo del hígado, por lo que ambos comparten en esta etapa temprana
la capacidad hematopoyética, aunque en este caso es mucho más limitada.
La tercera etapa o definitiva es la etapa del tuétano rojo, iniciando en el segundo trimestre de embarazo. Después del nacimiento el hígado deja de producir eritrocitos, por lo que el tuétano se convierte en el único sitio para la formación de la sangre humana.
Figura 63. El modelo anterior
muestra el desarrollo de las etapas hematopoyéticas por meses. La etapa
vitelina llega hasta el tercer mes de embarazo. La etapa heática inicia en el
primer mes y continua hasta el nacimiento, en medio de esta el bazo produce
eritrocitos entre el tercer y el sexto mes. La etapa definitiva o del tuétano
rojo da inicio en el cuarto mes de embarazo y continua por el resto de la vida
del individuo.
De acuerdo a la teoría monofilética del nacimiento de la sangre, todos los elementos celulares de la sangre, incluyendo las plaquetas se derivan filogenéticamente de un solo ancestro común, una célula madre pluripotencial que se encuentra en el tuétano y en los tejidos de los órganos hematopoyéticos embrionarios. Por muchos años se acumuló evidencia circunstancias de que las células de la sangre derivaban de un único progenitor directo, pero no fue aceptada como teoría científica hasta que se logró aislar la célula madre hematopoyética o HSC por sus siglas en ingles. La célula madre hematopoyética se clasifica como célula madre pluripotente dado que solo es capaz de diferenciarse en algunos tipos de células de un mismo tipo de tejido o de tejidos muy semejantes entre sí, aunque también es capaz de la auto-regeneración.
Estudios recientes ha dado evidencia de las HSC son
multipotentes, es decir, que poseen potencialmente la capacidad de generar
otros tejidos no relacionados con la sangre, contribuyendo a la regeneración
celular de varios tipos de tejidos y órganos. Durante el desarrollo embrionario
las HSC se encuentran distribuidas por el torrente sanguíneo, y experimentan
una diferenciación tisular en diferentes órganos.
Las HSC humanas han sido aisladas en el cordón umbilical, el
hígado fetal, así como en el tuétano rojo fetal y del adulto. En el adulto
poseen el potencial de reparar tejidos bajo condiciones patológicas como las
isquemias y el fallo de un órgano. Las HSC poseen receptores de membrana
específicos como los CD34 y CD90 que permite identificarlas y aislarlas de
otras células hematopoyéticas.
La HSC hacen dos cosas, la primera se regeneran a sí mismas,
y la segunda, generan múltiples colonias de células madre progenitoras
pluripotenciales más limitadas. Dos son las colonias más importantes: la línea
mieloide común o CMP por sus siglas en inglés y la línea común linfoide o CLP
por sus siglas en inglés. ¿Qué significa esto? Básicamente que hay dos linajes,
el primero es el de los linfocitos verdaderos, mientras que el otro linaje son
todas las demás células. Hay que destacar que los progenitores son todos
semejantes morfológicamente, por lo que no vale la pena moscrar sus
microfotografías, estos se distinguen por marcadores inmunológicos de membrana
de tipo CD.
El progenitor linfoide común o CLP es capaz de diferenciarse
en los linfocitos más comunes que llamamos B y T, pero también genera un tercer
tipo de linfocito menos famoso denominada célula asesina natural o NK por sus
siglas en inglés.
Este se divide a su vez en dos linajes.
El primer grupo es el leucocitario que da lugar a la mayoría
de leucocitos que vismoa anteriormente como los basófilos, eosinófilos,
neutrófilos y monocitos, pero también da lugar a otras células involucvradas en
el sistema inmune menos famosas llamadas mastocitos.
El segundo sublinaje es el que da lugar a los elementos
comunes de la sangre, los eritrocitos y las plaquetas.
Ya hemos mencionado las propiedades de cada uno de los productos maduros, excepto de los mastocitos, que por alguna razón son omitidos en algunos textos de fisiología médica, aunque prometo trabajarlos cuando veamos en sistema inmune en pleno. El enfoque de las siguientes secciones es lo que sucede entre los progenitores hasta las versiones casi maduras de cada uno de los elementos celulares de la sangre. De este modo analizaremos la línea linfoide, la línea granuloide y la línea eritroide.
Figura 64. Las células progenitoras.
Es el progenitor de los eritrocitos y de las plaquetas. Los eritrocitos de desarrollan a partir de células CMP que, bajo la influencia de la eritropoyetina, se diferencian en células MEP. Para la diferenciación terminal de las células MEP en el linaje eritroide definitivo es necesaria la expresión del factor de transcripción GATA-1. Bajo la acción de este factor las células MEP se transforman en progenitores sensibles de a la eritropoyetina predestinadosa convertirse en eritrocitos que dan origen al proeritroblasto.
Figura 65. El linaje eritroide.
Hay dos precursores indistinguibles al microscopio, el eritroide
que da lugar a los glóbulos rojos y el megacarioide que da lugar a las
plaquetas.
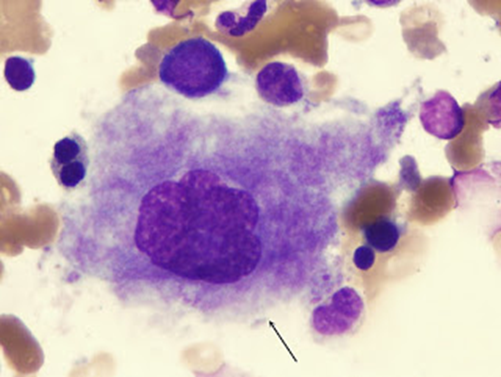
Primer precursor distinguible de los megacariocitos. Son células redondeadas u ovales de un diámetro aproximado de entre 15 y 25 micras. Frecuentemente son binucleadas, poseyendo el núcleo varias invaginaciones y varios nucleolos. Las masas de cromatina son más densas que las del mieloblasto. Tiene citoplasma basófido agranular con pequeñas mitocondrias, un aparato de Golgi relativamente bien desarrollado, algunas cisternas de retículo rugoso y moderado número de ribosomas libres. El megacarioblasto se diferencia durante la trombopoyesis hacia promegacariocito.
Figura 66. Megacarioblasto.
Son unas células muy grandes y conspicuas que forman parte del tejido hematopoyético de la médula ósea y de otros tejidos hematopoyéticos. Se trata de una célula muy grande (mide unos 30 μm de diámetro), poliploide y polinucleada, con numerosas ramificaciones. La participación del megacariocito en la hematopoyesis (formación de los elementos formes de la sangre) se limita a la producción de las plaquetas o trombocitos. Para formar las plaquetas, los megacariocitos liberan fragmentos de su citoplasma directamente a un vaso sinusoide (vaso poroso), pasando así a la circulación sanguínea. El proceso madurativo desde la célula madre hasta megacariocito, posteriormente a trombocitos se denomina trombopoyesis.
Figura 67. Megacariocito.
En condiciones normales se encuentra en la médula ósea de 1 a 4%. Es una célula ovoide, su núcleo es el doble de un hematíe normal con un diámetro de 14-19 μm. Esta célula capta el hierro circulante en el plasma y lo almacena para su uso posterior. Da origen por divisiones mitóticas al eritroblasto basófilo. Núcleo: Grande, redondo, de color púrpura claro con cromatina laxa uniforme dispuesta en forma filamentosa, puede tener de 2 a 3 nucleolos rodeados de cromatina intensa y la relación nucleo – citoplasma se encuentra aumentada. Citoplasma: Escaso, basófilo por la gran cantidad de ácidos nucleicos presentes y que son útiles para la producción de proteínas que se emplearán en la síntesis de hemoglobina.
Figura 68. Proeritroblasto.
Los eritroblastos son células eritropoyéticas. El proceso de producción de eritrocitos o glóbulos rojos pasa por varios estados eritroblásticos. En la línea de eritropoyesis, el primer eritroblasto presente en humanos (que proviene del proeritroblasto) se denomina eritroblasto basófilo. Este eritroblasto es pequeño, de unas 12 micras, y posee un citoplasma basófilo debido a la presencia de abundantes ribosomas encargados de sintetizar la hemoglobina (la proteína que transporta el oxígeno). El eritroblasto basófilo capta ferritina de la sangre por pinocitosis para aumentar su contenido en hierro.
Figura 69. Eritroblastos.
Del eritroblasto basófilo se diferencia el eritroblasto
policromatófilo cuando su contenido de hemoglobina pasa a ser muy alto. Esto
sucede porque esta proteína es ácidófila y enmascara la afinidad por tintes
básicos de los ribosomas. Su cromatina está más condensada que en estados
anteriores.
El siguiente estado en la transformación es el eritroblasto
ortocromático, eritroblasto ortocromatófilo o normoblasto. Puesto que los
eritrocitos son acidófilos por definición, el prefijo de estos eritroblastos
incide en que ya poseen esta característica acidofilia. Esta modificación se
debe a una menor presencia de ribosomas, porque ya no se requiere una síntesis
de hemoglobina activa. El normoblasto sufre la pérdida del núcleo (que es
fagocitado por macrófagos) dando lugar al reticulocito o eritrocito inmaduro.
Tras unos días de maduración en la médula ósea finalmente la abandona entrando
en el torrente sanguíneo y pasando a ser un eritrocito maduro. En vertebrados
no mamíferos la pérdida del núcleo no siempre sucede, manteniéndose por tanto
eritrocitos nucleados en el torrente sanguíneo.
Son glóbulos rojos que no han alcanzado su total madurez. Se
encuentran en niveles elevados en el plasma sanguíneo por causa de algunas
anemias, cuando el organismo incrementa la producción de glóbulos rojos y los
envía al torrente sanguíneo antes de que sean maduros.1 Los reticulocitos se
caracterizan por presentar una red de filamentos y gránulos que hacen que se
tiñen en el frotis de sangre, distinguiéndose así de los glóbulos rojos
maduros. Normalmente representan el 0,5-1,5% del conteo de glóbulos rojos, pero
pueden exceder el 4% cuando compensan la anemia.
Los reticulocitos son células anucleadas predecesoras de los eritrocitos con la diferencia de que poseen gránulos de ribosomas y algunas mitocondrias que les son útiles para sintetizar el 35 % de la hemoglobina restante. Este tipo de células está en la circulación periférica aproximadamente un día para convertirse posteriormente en un hematíe maduro que cumplirá con todas las funciones biológicas de estas células. A diferencia de los hematíes o glóbulos rojos maduros, los reticulocitos aún poseen ARN. El reticulocito es la célula roja que antecede en maduración al eritrocito, es el resultado de la pérdida del núcleo que sufre el eritroblasto ortocromático. Su tamaño varía de 10 - 15 micras de diámetro.
Figura 70. Reticulocito.
El reticulocito tiene una vida media de dos días en médula
ósea, de allí sale a la circulación donde requiere un día para convertirse en
célula roja madura. Durante este período sintetiza el 20% de la hemoglobina
contenida en la célula roja. Se han propuesto varios mecanismos mediante los
cuales el reticulocito finaliza su maduración: autofagia y eyección de
orgánulos no necesarias, acción "pitting" del bazo y degradación
bioquímica por medio de la 5 pirimidín nucleotidasa.
La eritropoyesis (del griego 'eritro', que significa "rojo", y "poiesis", que significa "hacer") es el proceso de producción de glóbulos rojos (eritrocitos). Se estimula mediante la disminución de O2 en la circulación, detectada por los riñones, que entonces secretan la hormona eritropoyetina. Esta hormona estimula la proliferación y diferenciación de los precursores de los glóbulos rojos, lo que activa el aumento de la eritropoyesis en los tejidos hematopoyéticos y, en última instancia, en la producción de glóbulos rojos. Por lo general, en las aves y los mamíferos (seres humanos incluidos) recién nacidos, esta se produce dentro de la médula ósea roja. En los fetos en desarrollo inicial, la eritropoyesis tiene lugar en las células mesodermales del saco vitelino. Al tercer o cuarto mes, la eritropoyesis se traslada al hígado. Transcurridos siete meses, la eritropoyesis tiene lugar en la médula ósea. El aumento de la actividad física puede producir un aumento de la eritropoyesis. Sin embargo, en humanos con ciertas enfermedades y en algunos animales, la eritropoyesis también puede tener lugar fuera de la médula ósea, en el bazo o en el hígado. Esta recibe el nombre de eritropoyesis extramedular. La médula ósea de prácticamente todos los huesos produce glóbulos rojos hasta que una persona alcanza aproximadamente los cinco años de edad. La tibia y el fémur dejan de ser centros de hematopoyesis alrededor de los 25 años de edad; las vértebras, el esternón, la pelvis, las costillas y los huesos del cráneo siguen produciendo glóbulos rojos durante el resto de la vida.
Figura 71. Eritropoyesis.
En el proceso de maduración del corpúsculo rojo, una célula
sufre una serie de diferenciaciones. Las siguientes etapas de desarrollo se
producen dentro de la médula ósea: (1) un hemocitoblasto, una célula madre
hematopoyética multipotente, se convierte en (2) un progenitor mieloide común o
en una célula madre multipotente, y luego (3) en una célula madre unipotente,
después (4) en un pronormoblasto, también comúnmente llamado proeritroblasto o
rubriblasto, después, (5) este se convierte en un normoblasmo basófilo o
temprano, también comúnmente llamado eritroblasto, después, (6) en un normoblasto
policromófilo o intermedio, luego (7) en un normoblasto ortocromático o tardío.
En esta etapa, el núcleo es expulsado antes de que la célula se convierta en un
reticulocito. La célula se libera de la médula ósea después de la séptima etapa
y, por lo tanto, en los glóbulos rojos de reciente circulación hay
aproximadamente un 1 % de reticulocitos. Tras uno o dos días, estos últimos se
convierten en "eritrocitos" o glóbulos rojos maduros.
Estas etapas se corresponden con aspectos específicos de la
célula cuando se tiñen con la tinción de Wright y se examinan mediante
microscopía óptica, y también se corresponden con otros cambios
bioquímicos. En el proceso de
maduración, un pronormoblasto basofílico se convierte de una célula con un
núcleo grande y un volumen de 900 fL a un disco enucleado con un volumen de 95
fL. En la etapa de reticulocitos, la célula ha extrudido su núcleo, pero
todavía es capaz de producir hemoglobina.
Esenciales para la maduración de los glóbulos rojos son la vitamina B12
(cobalamina) y la vitamina B9 (ácido fólico). La carencia de cualquiera de las
dos hace que la maduración fracase en el proceso de eritropoyesis, que se
manifiesta clínicamente como reticulocitopenia, una cantidad anormalmente baja
de reticulocitos.
A medida que maduran, cambian algunas características de los
eritrocitos: El tamaño de la célula se reduce y la matriz citoplásmica aumenta
en cantidad y la reacción de tinción del citoplasma cambia de azul a rojo
rosado debido a la disminución de la cantidad de ARN y ADN. Inicialmente, el
núcleo es de gran tamaño y contiene cromatina abierta. Pero a medida que los
glóbulos rojos maduran el tamaño del núcleo disminuye y finalmente desaparecen
con la condensación del material de la cromatina
En cada una de las etapas de desarrollo de la eritropoyesis
desde el proeritroblasto al eritroblasto al normoblasto al reticulocito implica
muchas divisiones mitóticas. Toma alrededor de una semana para que los
reticulocitos inmaduros inicien su migración al torrente sanguíneo.
Prácticamente todos los eritrocitosmaduran justo en los espacios intersticiales
de la matriz extracelular de la médula ósea y llegan al torrente sanguíneo
maduros. La médula ósea no es capaz de almacenar eritrocitos.
La eritropoyesis es un proceso regulado por la hormona
eritropoyetina, una glicoproteína con función hormonal, y segregada por el
riñón en respuesta a la detección de cantidades bajas de oxígeno en la sangre
circulante. La eritropoyetina como toda hormona se acopla a receptores
específicos de los precursores estimulando su proliferación y diferenciación.
Cuando los eritrocitos llegan al torrente sanguíneo elevan la cantidad de
oxígeno circulante, y al eritropoyetina deja de segregarse. De allí en adelante
la cohorte de eritrocitos funcionará por 120 días, hasta que pierden
elasticidad en sus membranas para pasar por los capilares del bazo, momento en
el cual los macrófagos los devoran. Los macrófagos lisan los eritrocitos, y
procesas su contenido que es casi que exclusivamente hemoglobina. Las globinas
se separan del grupo heme, siendo reprocesadas para hacer parte de las reservas
de aminoácidos en espera de una síntesis de más proteínas, mientras que el
grupo heme es liberado de su hierro para formar hemosiderina o ferritina, y es
almacenada para sintetizar nueva hemoglobina. Parte del entramado del grupo
heme no puede reciclarse, y es convertido en bilirrubina, la cual se enlaza a
la albumina y es liberada al torrente sanguíneo donde el hígado la captura y la
excreta por medio de la bilis.
Las cohortes de producción y destrucción son procesos
continuos, generándose un estado cíclico homeostático de retroalimentación en
el que interviene la eritropoyetina que ayuda a regular el proceso de
eritropoyesis de modo que, en fases que no pertenecen a una enfermedad, la
producción de glóbulos rojos se equipara a la destrucción de glóbulos rojos y
el número de glóbulos rojos es suficiente para mantener los niveles de oxígeno
necesarios en los tejidos pero no tan altos como para causar lodo, trombosis o
accidente cerebrovascular. La eritropoyetina se produce en el riñón y el hígado
en respuesta a bajos niveles de oxígeno. Además, la eritropoyetina está unida
por los glóbulos rojos en circulación: a un número bajo de eritrocitos en
circulación se corresponde un nivel relativamente alto de eritropoyetina
liberada, que estimula su producción en la médula ósea.
Algunos estudios recientes también han demostrado que la
hormona peptídica hepcidina puede desempeñar un papel importante en la regulación
de la producción de hemoglobina y, por lo tanto, influir en la eritropoyesis.
El hígado produce hepcidina. La hepcidina controla la absorción de hierro en el
tracto gastrointestinal y la liberación de hierro del tejido
reticuloendotelial. El hierro debe ser liberado de los macrófagos en la médula
ósea para ser incorporado en el grupo hemo de la hemoglobina en los
eritrocitos. Hay unidades que forman colonias y que las células siguen durante
su formación. Estas células se denominan células comprometidas incluyendo las
unidades formadoras de colonias de monocitos formadas por granulocitos.
La secreción de hepcidina es inhibida por otra hormona,
eritroferrona, producida por eritroblastos en respuesta a eritropoyetina, e
identificada en 2014. Parece que esta vincula la eritropoyesis impulsada por la
eritropoyetina con la movilización de hierro necesaria para la síntesis de la
hemoglobina. La pérdida de función del
receptor de la eritropoyetina o JAK2 en las células de los ratones causa falla
en la eritropoyesis, por lo que la producción de glóbulos rojos en los
embriones y el crecimiento se interrumpen. Si no existiese una inhibición de la
retroalimentación, como por ejemplo, la realizada por los supresores de
proteínas de señalización (citoquinas) en el sistema, se produciría gigantismo
en los ratones.















No hay comentarios:
Publicar un comentario